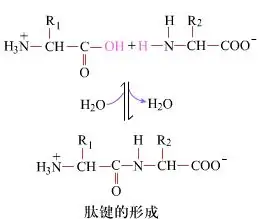
Paviršiuje peptidinių jungčių susidarymas, iš kurių susidaro dipeptidai, yra paprastas cheminis procesas.Tai reiškia, kad du aminorūgščių komponentai yra susieti peptidine jungtimi, amidine jungtimi, o dehidratuoti.
Peptidinės jungties susidarymas yra aminorūgšties aktyvavimas švelniomis reakcijos sąlygomis.(A) karboksilo fragmentas, antroji aminorūgštis (B) Tada nukleofilinė aktyvuota karboksilo dalis sudaro dipeptidą (AB)."Jei karboksilo komponentas (A) nėra apsaugotas, peptidinės jungties susidarymas negali būti kontroliuojamas."Šalutiniai produktai, tokie kaip linijiniai ir cikliniai peptidai, gali būti maišomi su tiksliniais junginiais AB.Todėl visos funkcinės grupės, nedalyvaujančios peptidinių jungčių formavime, peptidų sintezės metu turi būti apsaugotos laikinai grįžtamu būdu.
Taigi, peptidų sintezė – kiekvienos peptidinės jungties formavimas – apima tris agregacijos etapus.
Pirmiausia reikia paruošti kai kurias aminorūgštis, kurias reikia apsaugoti, o cviterioninė aminorūgščių struktūra nebeegzistuoja.
Antrasis etapas yra dviejų pakopų reakcija, sukurianti peptidinius ryšius, kai N-apsaugotos aminorūgšties karboksilo grupė pirmiausia aktyvuojama iki aktyvaus tarpinio junginio, o po to susidaro peptidinė jungtis.Ši susieta reakcija gali vykti kaip vienos pakopos reakcija arba kaip dvi nuoseklios reakcijos.
Trečias žingsnis – pasirinktinis arba visiškas apsauginio pagrindo pašalinimas.Nors visas pašalinimas gali įvykti tik sumontavus visas peptidines grandines, norint tęsti peptidų sintezę, taip pat reikia selektyviai pašalinti apsaugines grupes.
Kadangi 10 aminorūgščių (Ser, Thr, Tyr, Asp, Glu, Lys, Arg, His, Sec ir Cys) turi šoninės grandinės funkcines grupes, kurioms reikalinga selektyvi apsauga, todėl peptidų sintezė apsunkinama.Laikinosios ir pusiau nuolatinės apsaugos pagrindai turi būti atskirti dėl skirtingų selektyvumo reikalavimų.Laikinos apsaugos grupės naudojamos kitame etape, kad atspindėtų laikiną aminorūgščių arba karboksilo funkcinių grupių apsaugą.Pusiau nuolatinės apsauginės grupės pašalinamos netrikdant jau susidariusių peptidinių ryšių ar aminorūgščių šoninių grandinių, kartais sintezės metu.
"Idealiu atveju karboksilo komponento aktyvavimas ir vėlesnis peptidinių jungčių susidarymas (sujungimo reakcijos) turėtų būti greitas, be raceminių ar šalutinių produktų susidarymo, o moliniai reagentai turėtų būti naudojami norint gauti didelį derlių."Deja, nė vienas cheminio sujungimo būdas neatitinka šių reikalavimų, o tik nedaugelis tinka praktinei sintezei.
Peptidų sintezės metu funkcinės grupės, dalyvaujančios įvairiose reakcijose, dažniausiai yra susietos su rankiniu centru, glicinas yra vienintelė išimtis, todėl yra galimas sukimosi pavojus.
Paskutinis peptidų sintezės ciklo etapas yra visų apsauginių grupių pašalinimas.Atrankinis apsauginių grupių pašalinimas yra svarbus peptidų grandinės pratęsimui, be reikalavimo visiškai pašalinti apsaugą dipeptidų sintezėje.Sintetinės strategijos turi būti kruopščiai suplanuotos.Priklausomai nuo strateginio pasirinkimo, N gali selektyviai pašalinti α-amino arba karboksilo apsaugines grupes.Terminas „strategija“ reiškia atskirų aminorūgščių kondensacijos reakcijų seką.Apskritai, yra skirtumas tarp laipsniškos sintezės ir fragmentų kondensacijos.Peptidų sintezė (taip pat žinoma kaip „įprastinė sintezė“) vyksta tirpale.Daugeliu atvejų laipsniškas peptidinės grandinės ilginimas gali būti susintetintas tik naudojant peptidinę grandinę trumpesniems fragmentams sintetinti.Norint susintetinti ilgesnius peptidus, tikslinės molekulės turi būti suskirstytos į atitinkamus fragmentus ir nustatyta, kad jos gali sumažinti diferenciacijos laipsnį C gale.Palaipsniui surinkus atskirus fragmentus, tikslinis junginys bus sujungtas.Peptidų sintezės strategija apima geriausio ir tinkamiausio apsauginio fragmento parinkimą, o peptidų sintezės strategiją – tinkamiausio apsauginių bazių derinio ir geriausio fragmentų konjugacijos metodo parinkimą.
Paskelbimo laikas: 2023-07-19